Конспект лекций
по общей химии
Продолжение. Начало см. в № 8, 12, 13, 20, 23, 25-26, 40/2004
Глава 5.
Окислительно-восстановительные
реакции
5.1. Определение степени окисления
Окислительно-восстановительными называют
реакции, сопровождающиеся переходом электронов
от одних атомов к другим. О переходе электронов
судят по изменениям степеней окисления атомов.
Если степень окисления атома изменилась, то
изменилось и его электронное окружение.
Существуют два способа определения степеней
окисления атомов: первый
– по
брутто-формуле
, второй
– по
структурной формуле
.
При определении степеней окисления атомов
первым способом используют правило: сумма
степеней окисления всех атомов, образующих
частицу, равна заряду частицы
. Для молекулы
такая сумма равна нулю, а для иона – его заряду.
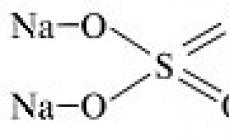
В качестве иллюстрации определим первым
способом степени окисления атомов в тиосульфате
натрия Na 2 S 2 О 3 . Среди элементов,
образующих частицу, наиболее
электроотрицательным является кислород – он и
будет принимать электроны. Поскольку кислород
находится в главной подгруппе VI группы, то для
завершения электронного слоя ему не хватает двух
электронов. Следовательно, атом кислорода примет
два электрона и обретет степень окисления –2.
Самый электроположительный атом – натрий, у
которого на внешнем электронном уровне всего
один электрон (его натрий и отдаст). Эти
рассуждения с учетом формулы тиосульфата натрия
позволяют составить уравнение:
2 (+1) + 2х + 3 (–2) = 0,
решение которого даст значение степени
окисления атома серы (+2).
Можно определить степени окисления атомов в
сложных ионах. В качестве примера рассмотрим
анион . В нем
наиболее электроотрицательный атом кислорода
принимает два электрона и обладает степенью
окисления –2. Степень окисления атома хрома
определяется из уравнения:
2х + 7 (–2) = –2
и равна +6.
Второй способ нахождения степеней окисления
атомов – по структурной формуле – основывается
на определении: степень окисления
– это
условный целочисленный заряд, который был бы на
атоме, если бы все его полярные ковалентные связи
стали ионными.
Изобразив структурную
формулу тиосульфата натрия

определим степени окисления его атомов.
Атомы натрия, соединенные одинарными связями с
более электроотрицательными атомами кислорода,
естественно, отдадут им свои внешние электроны,
обретя каждый степень окисления +1. Атомы
кислорода, имеющие по две связи с более
электроположительными атомами, условно примут
по два электрона и будут обладать степенью
окисления –2. Из структурной формулы видно, что в
соединении находятся два атома серы в разном
окружении. Один из атомов S соединен только
двойной связью с другим атомом S, и его степень
окисления равна нулю. Второй атом серы имеет
четыре связи с тремя более
электроотрицательными атомами кислорода и,
следовательно, обладает степенью окисления +4.
Средняя степень окисления атомов серы, как и при
определении ее первым способом, равна +2 ((+4+0)/2).
Атом кислорода не всегда имеет степень окисления
–2. Например, в его соединении с атомами фтора он
обладает положительной степенью окисления . В пероксидах
степень окисления каждого атома кислорода равна , в надпероксидах –
лишь , а в
озонидах – даже .
Также у атома серы степень окисления может быть
равна –1, например в дисульфидах . В некоторых оксидах, например Fe 3 О 4
и Pb 3 O 4 , cтепени окисления атомов
определяют, исходя из того, что эти оксиды
смешанные: Fe 2 O 3 FeO и PbO 2 2PbO
соответственно.
5.2. Составление уравнений
окислительно-восстановительных реакций
Подбор коэффициентов в уравнениях окислительно-восстановительных реакций осуществляют, составляя электронный баланс. Метод подбора, сводящийся к подсчету количеств атомов в правой и левой частях уравнения, не всегда гарантирует правильное определение коэффициентов. Так, в трех приведенных ниже уравнениях окисления триэтиламина азотной кислотой содержатся равные количества атомов углерода, водорода, кислорода и азота в левой и правой частях, но реализуется только одно из них:
4(С 2 Н 5)3N + 36НNО 3 = 24СО 2 + 48Н 2 О + 6NO 2 + 17N 2 ,
2(С 2 Н 5)3N + 78НNО 3 = 12СО 2 + 54Н 2 О + 78NO 2 + N 2 ,
(С 2 Н 5) 3 N + 11НNО 3 = 6СО 2 + 13Н 2 О + 4NO 2 + 4N 2 .
Теория окислительно-восстановительного
процесса предполагает передачу электронов от
атомов восстановителя атомам окислителя.
Согласно закону сохранения материи суммарное
количество электронов, отданных
восстановителем, равно суммарному количеству
электронов, принятых окислителем. Этой простой
идеей руководствуются при составлении уравнений
окислительно-восстановительных реакций. Задача
состоит в подборе коэффициентов
пропорциональности, при которых достигается
электронный баланс.
Разберем пример окисления молекулы этилбензола
перманганатом калия в кислой среде при
нагревании. Запишем уравнение реакции и укажем
степени окисления тех атомов, которые изменили
ее, причем их степени окисления в молекулах
этилбензола и бензойной кислоты определим,
пользуясь соответствующими структурными
формулами:

Атом углерода, непосредственно связанный с бензольным кольцом, изменит степень окисления от –2 до +3 (отдаст 5 электронов). Атом углерода метильной группы поменяет степень окисления от –3 до +4 в диоксиде углерода (отдаст 7 электронов). В сумме молекула этилбензола отдаст 12 электронов. Атом марганца изменит степень окисления от +7 до +2 (примет 5 электронов). В таком случае имеем уравнение:
12х = 5y ,
минимальные положительные целочисленные
решения которого равны х
= 5, у
= 12.
Подбор коэффициентов в уравнениях реакцией
диспропорционирования методом электронного
баланса необходимо осуществлять по правой их
части. В качестве примера разберем
диспропорционирование бертолетовой соли (без
катализатора):
![]()
Из изменений степеней окисления атомов в ходе
реакции вытекает, что принял 6 электронов, а якобы отдал 2 электрона.
Тогда
(КСl) = 3(КClО 4).
Следовательно, необходимо перед перхлоратом калия KClO 4 поставить коэффициент 3:
4КClО 3 = КСl + 3КClO 4 .
5.3. Электролиз
Разложение электролита (в растворе или
расплаве) при прохождении через него
электрического тока называют электролизом
.
Приборное оформление процесса электролиза
сводится к тому, что два электрода, подключенные
к источнику тока, опускают в сосуд с раствором
или расплавом электролита (рис. 5.1).
Отрицательно заряженный электрод
называется катодом
(к нему притягиваются
катионы), а положительно заряженный электрод – анодом
(он притягивает анионы). Электрическая цепь
замыкается за счет
окислительно-восстановительных процессов,
проходящих на электродах. На катоде происходит
восстановление катионов, а на аноде – окисление
анионов.
Начнем рассмотрение процесса с наиболее
простого случая – электролиза расплавов.
При
электролизе расплавов на катоде
восстанавливаются катионы металла до чистого
металла, а на аноде
простые анионы окисляются
до простого вещества, например:
2Сl – – 2е = Сl 2 ,
S 2– – 2е = S.
Если анион имеет сложное строение, то в этом случае протекает процесс, требующий наименьших затрат энергии. Если соль устойчива к нагреванию и атом элемента в анионе находится в наивысшей степени окисления, то обычно окисляется кислород до простого вещества:
– 2е = SO 3 + 1/2О 2 .
Если атом элемента находится в промежуточной степени окисления, то наиболее вероятно, что в этом случае будет окисляться не кислород, а атом другого элемента в анионе, например:
– e = NO 2 .
Электролиз в растворах более сложен с точки зрения определения продуктов. Связано это с появлением еще одного компонента – воды. Металлы со стандартными электродными потенциалами от –1,67 В (Al) и ниже (находящиеся левее марганца в ряду напряжений металлов) из водных растворов, как правило, не восстанавливаются. В таких системах на катоде выделяется водород. Связано это прежде всего с тем, что указанные металлы (в том числе магний и алюминий без защитной окисной пленки) реагируют с водой. Но это отнюдь не означает, что электродные процессы типа
Na + + e = Na
в водных растворах не происходят. Один из
способов получения металлического натрия –
электролиз водного раствора NаСl (рассола). Секрет
данного процесса кроется в использовании
ртутного катода. Восстановившиеся атомы натрия
поглощаются слоем ртути, предохраняющим их от
контакта с водой. Последующее разделение на
компоненты образовавшейся амальгамы натрия
(амальгама – сплав, один из компонентов которого
ртуть) достигается ректификацией.
Освободившаяся ртуть затем возвращается в
рабочий цикл.
О невозможности получения взаимодействующих с
водой металлов посредством электролиза водных
растворов соответствующих электролитов
свидетельствует также следующее рассуждение.
Пусть при электролизе водного раствора на катоде
произошло восстановление кальция:
Са 2+ + 2e = Ca.
Металл, восстановившись, вступит в реакцию с водой:
Са + 2Н 2 О = Са(ОН) 2 + Н 2 .
Следовательно, вместо металла на катоде
выделится водород.
Металлы со стандартными электродными
потенциалами в интервале от –1,05 В до 0 В
(находящиеся в электрохимическом ряду между
алюминием и водородом) из водных растворов
восстанавливаются параллельно с водородом.
Соотношение продуктов (металл и водород)
определяется концентрацией раствора, его
кислотностью и некоторыми другими факторами
(наличие других, особенно комплексных, солей в
растворе; материал, из которого изготовлен
электрод). Чем выше концентрация соли, тем больше
доля выделившегося металла. Чем более кислая
среда, тем более вероятно выделение
водорода.Металлы с положительными стандартными
электродными
потенциалами (находящиеся в ряду напряжений
металлов правее водорода) выделяются при
электролизе растворов в первую очередь.
Например:
Ag + + e = Ag.
На аноде при электролизе водных растворов окисляются все простые анионы, за исключением фторида. Например:
2I – – 2e = I 2 .
Фтор нельзя получить электролизом водных растворов, т.к. он реагирует с водой:
F 2 + Н 2 O = 2НF + 1/2О 2 .
Если соль, подвергающаяся электролизу, содержит сложный анион, в котором гетероатом (не кислород) находится в наивысшей степени окисления, то в этом случае на аноде образуется кислород, т.е. происходит разложение воды:
H 2 O – 2e = 2H + + 1/2O 2 .
Источником кислорода может также служить сам сложный анион:
– 2е = SO 3 + 1/2О 2 .
Образовавшийся при этом ангидрид кислоты тут же прореагирует с водой:
SО 3 + Н 2 О = Н 2 SO 4 .
Когда гетероатом находится в промежуточной степени окисления, окисляется он, а не атом кислорода. Примером такого процесса является окисление сульфит-иона под действием электрического тока:
![]()
Образующийся при этом серный ангидрид SО 3
тут же реагирует с водой.
Анионы карбоновых кислот в результате
электролиза декарбоксилируются, образуя
углеводороды:
2R–COO – – 2e = R–R + 2CO 2 .
5.4. Направление окислительно-
восстановительных процессов
и влияние на него кислотности среды
Мерой окислительно-восстановительной способности веществ в водных растворах служат окислительно-восстановительные или стандартные электродные потенциалы. Определим, например, может ли катион железа Fe 3+ окислить анионы галогенов в KCl, KBr и KI. Зная стандартные электродные потенциалы ( 0), можно вычислить электродвижущую силу (ЭДС) процесса. Она определяется как разность таких потенциалов окислителя и восстановителя, причем реакция протекает при положительном значении ЭДС:
![]()
Таблица 5.1
Определение возможности протекания
окислительно-восстановительных процессов
на основе стандартных электродных потенциалов
Табл. 5.1 показывает, что только один из исследуемых процессов возможен. Действительно, из всех указанных выше галогенидов калия с трихлоридом железа реагирует только КI:
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl.
Существует и другой простой способ определения направления процеccа. Если записать одно под другим два уравнения полуреакций процесса так, чтобы стандартный электродный потенциал верхней полуреакции был меньше, чем нижней, то написанная между ними буква Z (рис. 5.2) укажет своими концами направления стадий разрешенного процесса (правило Z).
Из одних и тех же веществ, изменяя рН среды, можно получить различные продукты. Например, перманганат-анион в кислой среде восстанавливается с образованием соединения марганца(II):
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = K 2 SO 4 + 2MnSO 4 + 5Na 2 SO 4 + 3H 2 O.
В нейтральной среде образуется диоксид марганца МnО 2:
2КМnО 4 + 3Nа 2 SO 3 + H 2 О = 2КОН + 2МnО 2 + 3Na 2 SO 4 .
В щелочной среде перманганат-анион восстанавливается до манганат-аниона:
2КМnО 4 + Nа 2 SO 3 + 2KOH = 2К 2 MnO 4 + Na 2 SО 4 + H 2 O.
5.5. Упражнения
1. Определите степени окисления атомов в следующих соединениях: BaO 2 , CsO 2 , RbO 3 , F 2 O 2 , LiH, F 2 , C 2 H 5 OH, толуол, бензальдегид, уксусная кислота.
В химии термины «окисление» и «восстановление» означает реакции, при которых атом или группа атомов теряют или, соответственно, приобретают электроны. Степень окисления - это приписываемая одному либо нескольким атомам численная величина, характеризующая количество перераспределяемых электронов и показывающая, каким образом эти электроны распределяются между атомами при реакции. Определение этой величины может быть как простой, так и довольно сложной процедурой, в зависимости от атомов и состоящих из них молекул. Более того, атомы некоторых элементов могут обладать несколькими степенями окисления. К счастью, для определения степени окисления существуют несложные однозначные правила, для уверенного пользования которыми достаточно знания основ химии и алгебры.
Шаги
Часть 1
Определение степени окисления по законам химии- Например, Al (s) и Cl 2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
- Обратите внимание, что аллотропная форма серы S 8 , или октасера, несмотря на свое нетипичное строение, также характеризуется нулевой степенью окисления.
-
Определите, состоит ли рассматриваемое вещество из ионов. Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений.
- Например, степень окисления иона Cl - равняется -1.
- Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и таким образом степень его окисления равна -1.
-
Учтите, что ионы металлов могут иметь несколько степеней окисления. Атомы многих металлических элементов могут ионизироваться на разные величины. Например, заряд ионов такого металла как железо (Fe) равняется +2, либо +3. Заряд ионов металла (и их степень окисления) можно определить по зарядам ионов других элементов, с которыми данный металл входит в состав химического соединения; в тексте этот заряд обозначается римскими цифрами: так, железо (III) имеет степень окисления +3.
- В качестве примера рассмотрим соединение, содержащее ион алюминия. Общий заряд соединения AlCl 3 равен нулю. Поскольку нам известно, что ионы Cl - имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия равна +3.
-
Степень окисления кислорода равна -2 (за некоторыми исключениями). Почти во всех случаях атомы кислорода имеют степень окисления -2. Есть несколько исключений из этого правила:
- Если кислород находится в элементарном состоянии (O 2), его степень окисления равна 0, как и в случае других элементарных веществ.
- Если кислород входит в состав перекиси , его степень окисления равна -1. Перекиси - это группа соединений, содержащих простую кислород-кислородную связь (то есть анион перекиси O 2 -2). К примеру, в составе молекулы H 2 O 2 (перекись водорода) кислород имеет заряд и степень окисления -1.
- В соединении с фтором кислород обладает степенью окисления +2, читайте правило для фтора ниже.
-
Водород характеризуется степенью окисления +1, за некоторыми исключениями. Как и для кислорода, здесь также существуют исключения. Как правило, степень окисления водорода равна +1 (если он не находится в элементарном состоянии H 2). Однако в соединениях, называемых гидридами, степень окисления водорода составляет -1.
- Например, в H 2 O степень окисления водорода равна +1, поскольку атом кислорода имеет заряд -2, и для общей нейтральности необходимы два заряда +1. Тем не менее, в составе гидрида натрия степень окисления водорода уже -1, так как ион Na несет заряд +1, и для общей электронейтральности заряд атома водорода (а тем самым и его степень окисления) должен равняться -1.
-
Фтор всегда имеет степень окисления -1. Как уже было отмечено, степень окисления некоторых элементов (ионы металлов, атомы кислорода в перекисях и так далее) может меняться в зависимости от ряда факторов. Степень окисления фтора, однако, неизменно составляет -1. Это объясняется тем, что данный элемент имеет наибольшую электроотрицательность - иначе говоря, атомы фтора наименее охотно расстаются с собственными электронами и наиболее активно притягивают чужие электроны. Таким образом, их заряд остается неизменным.
-
Сумма степеней окисления в соединении равна его заряду. Степени окисления всех атомов, входящих в химическое соединение, в сумме должны давать заряд этого соединения. Например, если соединение нейтрально, сумма степеней окисления всех его атомов должна равняться нулю; если соединение является многоатомным ионом с зарядом -1, сумма степеней окисления равна -1, и так далее.
- Это хороший метод проверки - если сумма степеней окисления не равна общему заряду соединения, значит вы где-то ошиблись.
Часть 2
Определение степени окисления без использования законов химии-
Найдите атомы, не имеющие строгих правил относительно степени окисления. По отношению к некоторым элементам нет твердо установленных правил нахождения степени окисления. Если атом не подпадает ни под одно правило из перечисленных выше, и вы не знаете его заряда (например, атом входит в состав комплекса, и его заряд не указан), вы можете установить степень окисления такого атома методом исключения. Вначале определите заряд всех остальных атомов соединения, а затем из известного общего заряда соединения вычислите степень окисления данного атома.
- Например, в соединении Na 2 SO 4 неизвестен заряд атома серы (S) - мы лишь знаем, что он не нулевой, поскольку сера находится не в элементарном состоянии. Это соединение служит хорошим примером для иллюстрации алгебраического метода определения степени окисления.
-
Найдите степени окисления остальных элементов, входящих в соединение. С помощью описанных выше правил определите степени окисления остальных атомов соединения. Не забывайте об исключениях из правил в случае атомов O, H и так далее.
- Для Na 2 SO 4 , пользуясь нашими правилами, мы находим, что заряд (а значит и степень окисления) иона Na равен +1, а для каждого из атомов кислорода он составляет -2.
- В соединениях сумма всех степеней окисления должна равняться заряду. Например, если соединение представляет собой двухатомный ион, сумма степеней окисления атомов должна быть равна общему ионному заряду.
- Очень полезно уметь пользоваться периодической таблицей Менделеева и знать, где в ней располагаются металлические и неметаллические элементы.
- Степень окисления атомов в элементарном виде всегда равна нулю. Степень окисления единичного иона равна его заряду. Элементы группы 1A таблицы Менделеева, такие как водород, литий, натрий, в элементарном виде имеют степень окисления +1; степень окисления металлов группы 2A, таких как магний и кальций, в элементарном виде равна +2. Кислород и водород, в зависимости от вида химической связи, могут иметь 2 различных значения степени окисления.
Определите, является ли рассматриваемое вещество элементарным. Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух, либо многоатомных молекул одного элемента.
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
В нейтральной молекуле сумма степеней окисления всех элементов равна нулю, а в ионе - заряду иона.
Несколько простых примеров на определение степеней окисления
Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3).
Решение . Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х - искомая степень окисления. Составляем простейшее уравнение: х + 3 (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 (+1) + х + 4 (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .
Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3) 3 .
Решение . Алгоритм остается неизменным. В состав "молекулы" нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 (+3) + 3х + 9 (-2) = 0. Ответ: Al +3 (N +5 O -2 3) 3 .
Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4) 3- .
Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5 . Определите степени окисления всех элементов в (NH 4) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота - нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую "молекулу", а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1) 2 S +6 O 4 -2 .
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте "разделить" молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Пример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH.
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Не смешивайте понятия "валентность" и "степень окисления"!
Степень окисления часто путают с валентностью . Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность - нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую "экзотику" здесь обсуждать не будем);
- степень окисления - формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие "валентность", наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему "Степень окисления"
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный тип.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе - заряду иона .
1. Степени окисления металлов в соединениях всегда положительные.
2. Высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключение составляют: Au +3 (I группа), Cu +2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru .
3. Степени окисления неметаллов зависят от того, с каким атомом он соединён:
- если с атомом металла, то степень окисления отрицательная;
- если с атомом неметалла то степень окисления может быть и положительная, и отрицательная. Это зависит от электроотрицательности атомов элементов.
4. Высшую отрицательную степень окисления неметаллов можно определить вычитанием из 8 номера группы, в которой находится данный элемент, т.е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы.
5. Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
Элементы с неизменными степенями окисления.
|
Элемент |
Характерная степень окисления |
Исключения |
|
Гидриды металлов: LIH -1 |
||
|
Степенью окисления называют условный заряд частицы в предположении, что связь полностью разорвана (имеет ионных характер). H - Cl = H + + Cl - , Связь в соляной кислоте ковалентная полярная. Электронная пара в большей степени смещена в сторону атома Cl - , т.к. он более электроотрицацельный элемент. Как определить степень окисления?Электроотрицательность - это способность атомов притягивать к себе электроны других элементов. Степень окисления указывается над элементом: Br 2 0 , Na 0 , O +2 F 2 -1 , K + Cl - и т.д. Она может быть отрицательной и положительной. Степень окисления простого вещества (несвязанное, свободное состояние) равна нулю. Степень окисления кислорода у большинстве соединений равна -2 (исключение составляют пероксиды Н 2 О 2 , где она равна -1 и соединения с фтором - O +2 F 2 -1 , O 2 +1 F 2 -1 ). - Степень окисления простого одноатомного иона равна его заряду: Na + , Ca +2 . Водород в своих соединениях имеет степень окисления равную +1 (исключения составляют гидриды - Na + H - и соединения типа C +4 H 4 -1 ). В связях «металл-неметалл» отрицательную степень окисления имеет тот атом, который обладает большей электрооприцательностью (данные об элеткроотрицательности приведены в шкале Полинга): H + F - , Cu + Br - , Ca +2 (NO 3 ) - и т.д. Правила определения степени окисления в химических соединениях.Возьмем соединение KMnO 4 , необходимо определить степень окисления у атома марганца. Рассуждения:
К + Mn X O 4 -2 Пусть Х - неизвестная нам степень окисления марганца. Количество атомов калия - 1, марганца - 1, кислорода - 4. Доказано, что молекула в целом электронейтральна, поэтому ее общий заряд должен быть равен нулю. 1*(+1) + 1*(X ) + 4(-2) = 0, Х = +7, Значит, степень окисления марганца в перманганате калия = +7. Возьмем другой пример оксида Fe 2 O 3 . Необходимо определить степень окисления атома железа. Рассуждение:
2*(Х) + 3*(-2) = 0, Вывод: степень окисления железа в данном оксиде равна +3. Примеры. Определить степени окисления всех атомов в молекуле. 1. K 2 Cr 2 O 7 . Степень окисления К +1 , кислорода О -2 . Учитывая индексы: О=(-2)×7=(-14), К=(+1)×2=(+2). Т.к. алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, то число положительных степеней окисления равно числу отрицательных. Степени окисления К+О=(-14)+(+2)=(-12). Из этого следует, что у атома хрома число положительных степеней равно 12, но атомов в молекуле 2, значит на один атом приходится (+12):2=(+6). Ответ: К 2 + Cr 2 +6 O 7 -2 . 2. (AsO 4) 3- . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е. - 3. Составим уравнение: х+4×(- 2)= - 3 . Ответ: (As +5 O 4 -2) 3- . |